大脑或脊髓损伤通常会导致胶质疤痕的产生。胶质疤痕是由密集的胶质细胞组成而且缺乏功能性神经元,是众所周知的抑制神经再生的障碍。2020年11月5日,广州暨南大学陈功教授领导的团队在最新一期《细胞神经科学前沿》杂志上发表文章,证明胶质疤痕组织可以通过神经再生型基因疗法逆转为神经活性组织。
胶质疤痕虽然起初可能有一定的保护功能,但它的长期存在严重抑制了神经元的生长和功能恢复。在过去的几十年甚至几个世纪里,医生和科学家们曾经试图通过手术切除或细胞分子生物学手段解决胶质疤痕的问题,但结果往往更糟糕。因此,胶质疤痕像一把双刃剑:一方面,它充当防御屏障,阻止损伤扩散到邻近的健康组织;但另一方面,它也抑制了疤痕内组织与疤痕外的健康组织之间的相互作用,阻碍了功能恢复。虽然大家都想把大脑或脊髓中的胶质疤痕去掉,但却不能通过杀死疤痕组织里的胶质细胞来达到这一目的,于是胶质疤痕就成了一个世纪性难题。
陈功教授团队设计了一个巧妙的方法来解决这个世纪难题:他们通过基因疗法将疤痕组织内的胶质细胞原位直接转化成了功能性神经元,从而将胶质疤痕组织逆转为功能性神经组织。陈功教授把他们发明的这项用病毒载体进行神经再生的技术称之为“神经再生型基因疗法”,因为这种基因疗法可以在成年哺乳动物的神经系统中再生新的神经元。最近,陈功教授团队已经发表了一系列的文章,证明了这种神经再生型基因疗法不仅可以将内源性胶质细胞转化为功能性神经元,而且可以在缺血性脑中风和亨廷顿舞蹈症小鼠模型上促进大脑功能的恢复。巧合的是,在2020年11月5日的同一天,陈功教授团队还发表了世界上首个非人灵长类大脑原位神经再生的工作,他们发现这种神经再生型基因疗法可以在缺血性脑中风模型的成年猴子大脑中将胶质细胞直接转化为神经元,为未来的临床应用打下了坚实的基础。
“我们发明的神经再生型基因疗法使用了目前安全性比较好的腺相关病毒(AAV)载体,将神经转录因子(比如NeuroD1)表达在因为神经损伤而引起的应激性星形胶质细胞里,并将它们直接转化为有生理功能的新神经元。有趣的是,因为我们运用AAV载体来表达特定的基因,因此这项新技术属于基因治疗的范畴;但是,我们基因疗法的结果却是再生新的神经元,而这又通常是细胞治疗的范畴。因此,我们的大脑原位神经再生技术横跨了基因治疗和细胞治疗这两大板块,同时也属于更广阔的再生医学范畴”,陈教授就他们发明的这一独特的新技术进行了解释。
“在这项研究中,我们将神经转录因子 NeuroD1 通过AAV载体递送到因为脑损伤而引起的应激性星形胶质细胞中,发现NeuroD1的表达不仅减少了有毒副作用的应激性星形胶质细胞,而且生成了功能性的新神经元。伴随胶质细胞向神经元的转化,剩余的星形胶质细胞可以再分裂从而自我补充。出乎意料的是,我们发现在把应激性星形胶质细胞转化为神经元以后,神经炎症也随之减少了,新血管出现了,血脑屏障也逐渐恢复。所有这一切导致了新的神经组织再生,其组成包括了新的神经元,新的胶质细胞,和新的血管”,第一作者张磊博士兴奋地谈起她的工作。
“值得一提的是,我们在这项研究中设计了两套实验,证明 NeuroD1 不仅在脑损伤后的短时间内可以将应激性星形胶质细胞转化为神经元,而且能够在长时程损伤后已经成形的疤痕组织里将星形胶质细胞转化为神经元,表明这种大脑原位神经再生技术可能具有比较广泛的治疗干预时间窗”,该研究的共同第一作者雷卓凡博士作了补充说明。
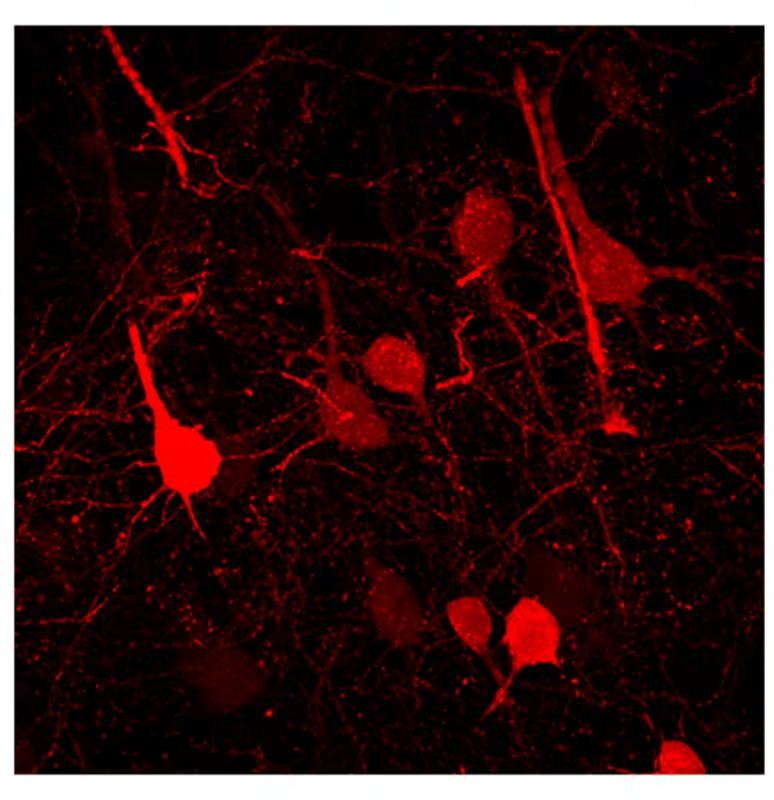
最后,陈功教授总结说:“这项神经再生型基因疗法实现了一石双鸟:它不仅再生了新的神经元,同时也减少了应激性胶质细胞,从胶质疤痕组织内部将其攻破,把胶质疤痕组织直接转化为富含功能性神经元的组织--这应该是解决长期悬而未决的胶质疤痕问题的有效方案”。
除了陈功教授、张磊博士、雷卓凡博士之外,这项工作的其他贡献者还包括在宾夕法尼亚州立大学完成实验的郭梓园博士、裴子菲博士、陈煜晨博士、张凤羽、Alice Cai, Gabriel Mok, Grace Lee, Vishal Swaminathan,王帆,和白玉婷。这项工作主要由查尔斯·史密斯捐赠基金资助完成。
原文链接:https://www.frontiersin.org/articles/10.3389/fncel.2020.594170/full