2021年12月22日,暨南大学粤港澳中枢神经再生研究院李晓江团队在国际著名期刊Autophagy(IF 16.016)杂志发表论文“SQSTM1 mediated clearance of cytoplasmic mutant TARDBP/TDP-43 in the monkey brain”(https://doi.org/10.1080/15548627.2021.2013653)。该研究通过对比灵长类猴与小鼠模型中TDP-43对SQSTM1基因的影响,又一次证明了利用非人灵长类动物模型研究神经退行性疾病的重要性。

肌萎缩侧索硬化(ALS)、额颞叶变性(FTLD)和阿尔茨海默(AD)等神经退行性疾病疾病均因错误折叠蛋白质的累积而导致。SQSTM1(Sequestosome 1又称p62)是一种多功能泛素结合蛋白,参与泛素蛋白酶体系统和自噬-溶酶体系统两种蛋白降解过程,可选择性清除错误折叠的蛋白质。 因此,其功能受损与错误折叠的蛋白质累积及神经退行性疾病密切相关。TDP-43为神经退行疾病的致病蛋白,正常情况下在神经细胞核中分布,参与基因转录抑制、RNA前体剪接等重要过程。当TDP-43基因发生异常突变时及在一些神经病理状况中,胞核中TDP-43会转移到胞浆中,造成神经细胞毒性。然而,在小鼠模型中绝大部份TDP-43仍累积在细胞核中,无法充分模拟病人脑中TDP-43在胞浆中聚集的病理特点。
基于大动物和小鼠在模拟神经退行性疾病重要病理变化的显著差异,李晓江团队曾在2019年将突变型TDP-43表达在灵长类猴和小鼠大脑中,发现TDP-43模型猴出现类似病人中细胞浆TDP-43聚集的病理特征,这与小鼠模型中所观察到的TDP-43在细胞核中累积截然不同。进一步研究发现仅在人和猴等高等动物中特异表达的水解酶caspase-4剪切TDP-43,使缺失核定位信号的TDP-43片段产物转移到胞浆中 (Yin et al., Acta Neuropathol, 2019)。 利用此猴模型,李晓江团队进一步发现胞浆中TDP-43能特异性结合灵长类SQSTM1(p62)mRNA 3’UTR中的(TG)n重复序列,促进猴SQSTM1 mRNA的不稳定性,造成其蛋白表达降低,功能受损。但小鼠中SQSTM1的3’UTR区缺乏较长的(TG)n重复序列而不被TDP-43结合,并无SQSTM1蛋白水平的变化。

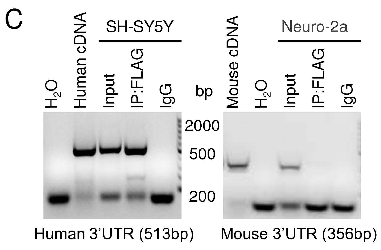
图1 灵长类SQSTM1的3’UTR区较长的(TG)n重复序列可结合TDP-43而小鼠中短的 (TG)n重复序列不结合TDP-43。
接下来,李晓江团队通过在TDP-43模型猴脑中表达病毒载体介导的SQSTM1,发现SQSTM1可恢复自噬清除TDP-43聚集体的能力,进一步解释了ALS/FTLD等疾病进程中的功能性SQSTM1对清除错误折叠蛋白的重要作用。该发现证明了非人灵长类动物模型与小鼠模型不同,能用来研究TDP-43在细胞浆的聚集与神经毒性。
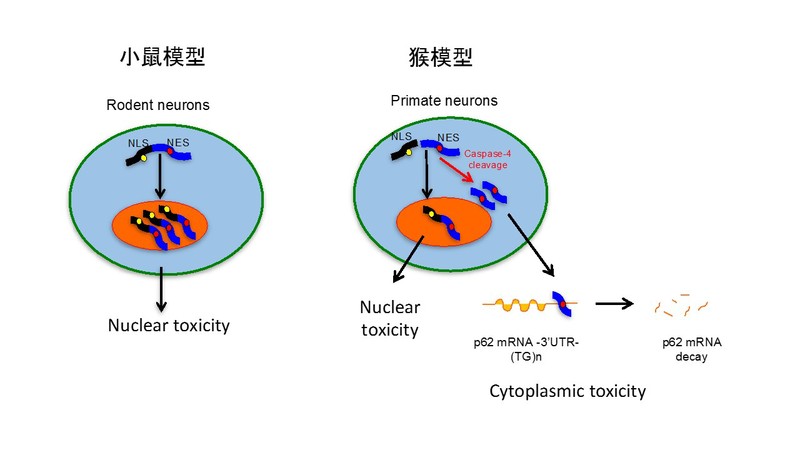
图2 灵长类中特有的水解酶caspase-4剪切TDP-43,使缺失核定位信号的TDP-43片段产物转移到胞浆并结合SQSTM1 mRNA而导致细胞浆的毒性。
结合近年来李晓江团队发现猪(Yan et al., Cell, 2018)及猴模型 (Yang et al., Cell Res. , 2019;Yang et al., Protein Cell, 2021)能更好地模拟神经退行性疾病的典型病理变化,且一些致病相关蛋白或基因序列仅存在于大动物中,该研究进一步证实了有必要利用大动物和非人灵长类动物模型来更准确揭示神经退行性疾病的分子机理及寻找到有效治疗方法。
论文第一作者及通讯作者为暨南大学殷鹏研究员,暨南大学郭祥玉、李邦副研究员等也参与了本项目的研究。暨南大学附属第一医院影像中心王璐研究员为猴影像学观察做出了重要贡献。暨南大学李世华教授和李晓江教授为文章的共同通讯作者。本研究获得广东省科技厅项目,科技部国家重点研发计划,国家自然科学基金及广东省非人灵长类动物模型研究重点实验室平台的资助。