2022年8月03日,广州医科大学附属第六医院齐玲课题组与暨南大学徐颖课题组在Stem Cell Research & Therapy (Q1, IF=8.079)杂志在线发表了题为Mesenchymal stem cell-derived extracellular vesicles protect retina in a mouse model of retinitis pigmentosa by anti-infammation through miR-146a-Nr4a3 axis的研究论文,论文阐明了间充质干细胞外小囊泡/外泌体(MSC-EVs/Exos)对RP模型小鼠(rd10小鼠)视网膜的保护作用并揭示其治疗的分子机制,为神经退行性疾病的治疗提供了新的治疗思路。

视网膜色素变性(RP)是一种不可逆转的致盲性眼科疾病,在临床上没有有效的治疗方式。干细胞治疗为RP提供了新希望,但也面临如伦理、免疫排斥、机制不明等问题。
MSC-EVs是间充质干细胞实现其旁分泌功能的主要实现者,且研究已明确其免疫原性小、无致癌风险、易于储藏和给药等优势。本研究通过玻璃体注射将MSC-EVs递送到RP小鼠模型rd10的病变视网膜中,发现其能够很好保护rd10小鼠的视网膜形态结构与功能(图1)、抑制视网膜中胶质细胞与巨噬细胞的激活。进一步通过RNA-seq、qPCR和WB明确了MSC-EVs能抑制rd10小鼠视网膜中炎症因子的表达及NF-κB信号通路的激活。同时,通过miRNA-seq也在MSC-EVs中检测到了多种功能性miRNA,可以调节NF-κB信号通路,其中表达量最高的前三个为miR-21-5p、miRNA-122-5p和miR-146a-5p。
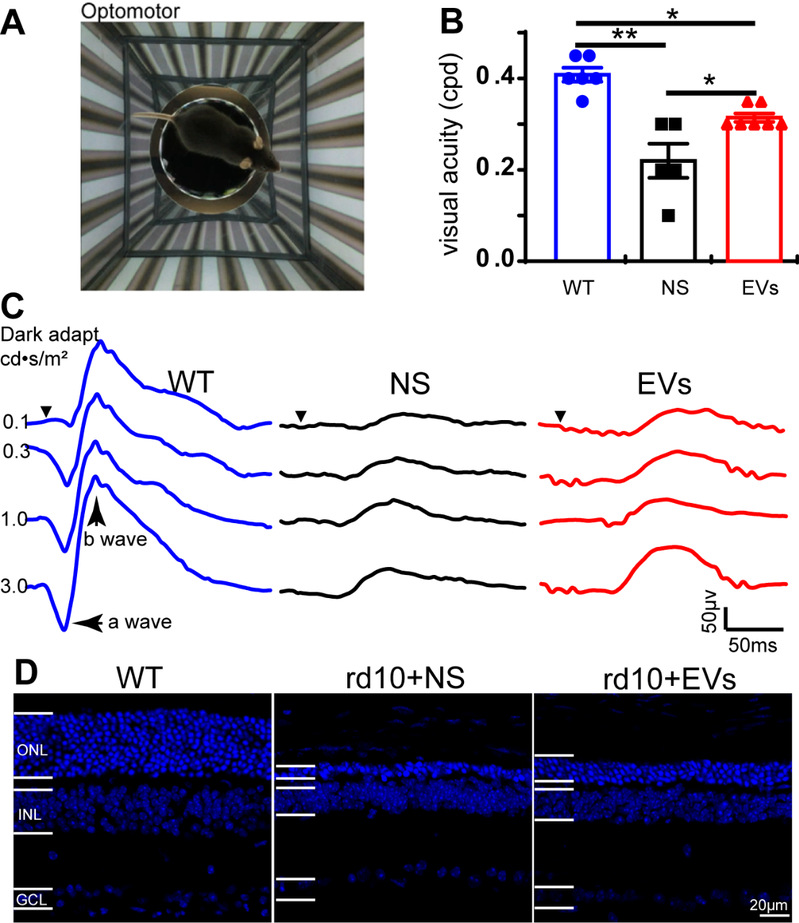
图1:MSC-EVs促进rd10小鼠视觉功能恢复和视网膜感光细胞的存活。
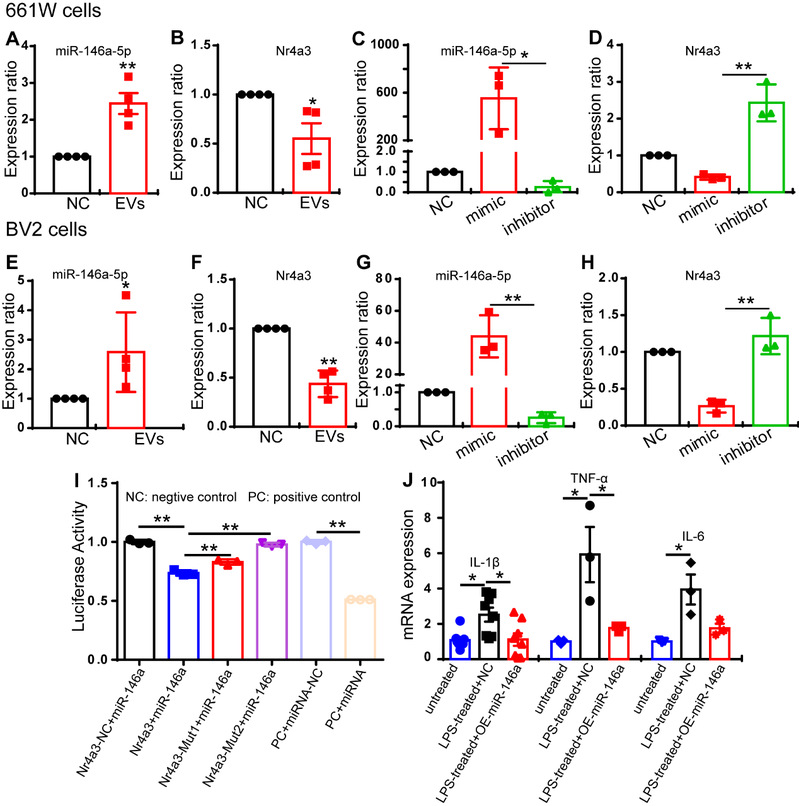
为了探索MSC-EVs的抗炎机制,作者构建了体外感光细胞系661W细胞和小胶质细胞系BV2细胞共培养体系。研究发现MSC-Evs可以显著抑制脂多糖(LPS)激活BV2细胞产生的炎症因子表达,并减少661W细胞的凋亡。为了进一步阐明抗炎的分子机制,作者首先寻找了可能调节rd10视网膜炎症的候选miRNA。通过测序和数据库分析,发现了MSC-EVs中高表达的10个miRNA可能作用的靶基因中有三个基因在MSC-EVs治疗后的rd10视网膜中有差异表达,分别为Fgl2、Hipk2、Gant2l。这个三个基因被预测为miR-21-5p、miR-146a-5p、miR-let-7a-5p的靶基因,但这三个基因在MSC-EVs处理后并未下调,而miRNA的主要功能为与AGO2结合形成沉默复合体,阻遏基因的表达。因此,作者转而关注经MSC-EVs治疗后的rd10视网膜中表达下调的基因,最后发现rd10与正常小鼠视网膜的2000多个差异表达基因中,有24个在MSC-EVs治疗后也有差异表达,其中有8个基因下调。因此,该研究通过生物信息学依次预测miR-21-5p、miR-146a-5p、miR-let-7a-5p是否能够直接调控这8基因,最终发现转录因子Nr4a3可能为miR-146a-5p的靶基因,并可能存在2个结合位点。
为了测试 miR-146a-5p 和 Nr43a-NF-κB 之间的关系,作者们再次使用共培养系统,通过敲降/过表达miR-146a-5p的水平,明确了在661W和BV2细胞中miR-146a-5p 对 Nr4a3表达的调控作用。随后作者进一步通过双荧光素酶报告基因测定实验,明确Nr4a3为MSC-EVs中miRNA-146a-5p的作用靶基因(图2)。因此证实MSC-EVS是通过miRNA-146a-5p-Nr4a3信号轴调控炎症因子的表达。
| | |
| | |
图2:miR-146a直接调控Nr4a3的表达并下调促炎因子的表达。
综上所述,MSC-EVs能够延缓rd10小鼠视网膜感光细胞的退变,并通过miRNA-146a-5p-Nr4a3信号轴实现强大的抗炎作用,为临床实现无细胞治疗提供了科学依据与理论基础。该文章首次阐明MSC-EVs抗炎的具体分子机制(图3),具有重要的研究意义。
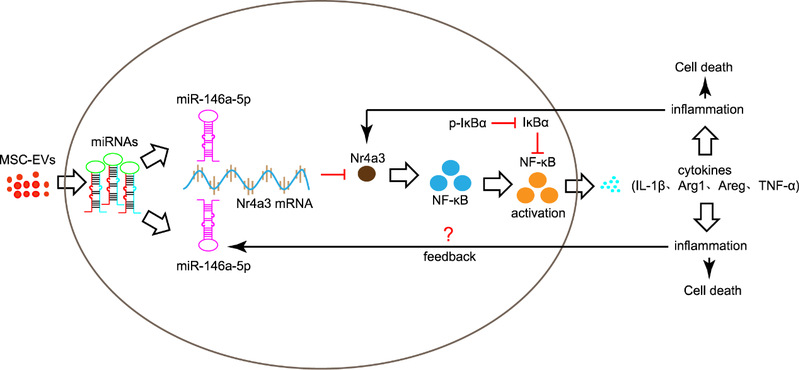
图3:MSC-EVs治疗的假设机制示意图。
广州医科大学附属第六医院齐玲教授与暨南大学粤港澳中枢神经再生研究院徐颖研究员为该论文共同通讯作者,广州医科大学附属第六医院张佳博士与李鹏东为该论文共同第一作者。该研究得到了国家自然科学基金、广东省基础与应用基础研究基金、广州市脑科学与类脑研究重大科技专项、广东省科技计划等项目的资助,主要在广州医科大学附属第六医院(清远市人民医院)完成。张佳在暨南大学粤港澳中枢神经再生研究院获得的神经生物硕士和博士学位,这项工作是他在广州医科大学附属第六医院的博士后工作站完成的工作。
文章链接:https://doi.org/10.1186/s13287-022-03100-x