衰老是不可控的生物学进程,随着医疗条件改善及社会经济的发展,人们的寿命显著增加,人口老龄化成为世界面临的巨大挑战。 越来越多的老年人罹患神经退行性疾病,包括老年痴呆( Alzheimer’s disease ) ,帕金森病(Parkinson’s disease, PD),肌萎缩侧索硬化症 (ALS), 以及单基因突变导致的遗传性亨廷顿疾病(Huntington’s disease, HD)等。这一类疾病的共同特征是随着衰老出现脑部特异性神经细胞变性死亡最终导致病人无法生存。 目前仍然缺乏有效治疗手段来延长或阻断病人的发病时间及疾病进程。基因治疗对于遗传性疾病,特别是单基因突变导致的神经退行性疾病,是一种前景非常可期的治疗策略。
2023年2月16日,暨南大学粤港澳中枢神经再生研究院李晓江教授,李世华教授,闫森研究员,联合中国科学院广州生物医药与健康研究院赖良学研究员在国际顶级杂志Nature Biomedical Engineering(影响因子 29.234)上发表题为“Cas9-mediated replacement of expanded CAG repeats in a pig model of Huntington’s disease”的研究论文 (https://www.nature.com/articles/s41551-023-01007-3)。该工作利用AAV病毒载体表达CRISPR/Cas9基因编辑的技术修复及敲除亨廷顿猪模型的突变基因,首次在国际上证明基因治疗能有效的改善神经退行性疾病大动物模型的病理变化以及行为症状。复旦大学教授鲁伯埙、中国科学技术大学教授申勇,以及美国加州大学洛杉矶分校教授杨向东对该研究进行了点评,认为该研究成果是治疗亨廷顿疾病动物模型的一个重要里程碑。

李晓江教授团队曾在2017年首次报道 CRISPR/Cas9可以有效治疗亨廷顿疾病小鼠模型 (Yang et al., 2017 J Clin Invest 影响因子 19.456 )。然而, 基因修饰的亨廷顿疾病小鼠模型并不表现出明显的神经细胞死亡特性。这一缺陷妨碍了利用小鼠模型来严格评价药物及基因治疗的有效性。由于大动物模型在大脑和结构功能上与人类更为相似。李晓江教授团队与赖良学研究员团队在2018年建立了国际首例基因敲入猪模型来模拟亨廷顿病的典型神经细胞死亡特性与运动功能障碍 (Yan et al., 2018 Cell影响因子 66.850)。该模型为基因治疗神经退行性疾病提供了一个重要的动物模型。
利用这个基因敲入猪模型,闫森等研究人员通过CRISPR/Cas9引起的同源臂重组将变异亨廷顿基因序列替换为正常人亨廷顿基因序列。同时还测试了脑部直接注射及周围静脉注射AAV病毒载体携带的CRISPR/Cas9对亨廷顿疾病模型猪的治疗作用, 两种方法都可以把变异亨廷顿基因序列替换为正常基因序列, 并能有效治疗大动物模型的病理变化以及运动症状。同时,该研究从多方面评估了这一治疗方法的安全性。亨廷顿疾病模型猪基因治疗的方式也为治疗其他神经退行性疾病提供了理论基础与新的思路。
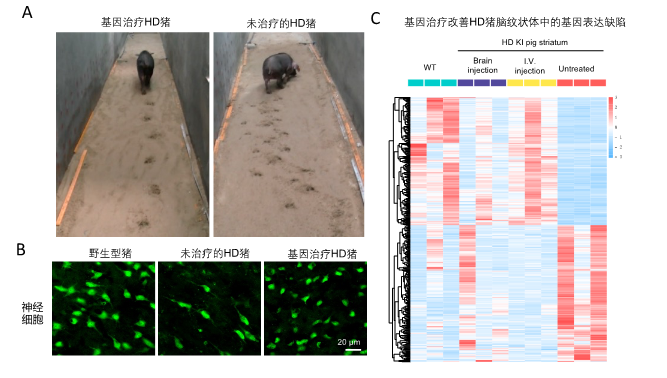
图 (A) 足印试验表明亨廷顿疾病模型猪(右侧猪)的运动障碍步及态紊乱可以通过脑注射AAV病毒载体表达CRISPR/Cas9对突变基因的修复而得到纠正(左侧猪)。(B) 基因治疗减少HD猪纹状体中的神经细胞死亡。(C)基因治疗改善HD猪脑纹状体中的基因表达缺陷。
暨南大学粤港澳中枢神经再生研究院李晓江教授,李世华教授,闫森研究员与中国科学院广州生物医药与健康研究院赖良学研究员为本文的共同通讯作者。闫森研究员为本文的第一作者。涂著池研究员,博士生郑潇,林颖琪,李彩娟,李嘉威,助理研究员刘朝明,赵宇等也为本研究做出重要贡献。本研究获国家自然科学基金,科技部国家重点研发计划,广东省科技厅,广东省非人灵长类动物模型研究重点实验室,广州市重点研发计划脑科学重大专项等基金的资助、教育部“中枢神经损伤与修复”创新引智计划等课题资助,并得到暨南大学的大力支持。