自闭症, 又称孤独症,是一种由脑部发育障碍所导致的疾病,我国儿童自闭症的患病率约为1%,目前尚无有效根治方法,严重影响患者的日常生活与社交能力。其中CHD8基因的突变与自闭症谱系障碍密切相关。CHD8 (chromodomain helicase DNA binding protein 8)基因编码一种ATP依赖性染色质重塑因子,其功能为调节基因转录。目前报道的携带CHD8基因突变的病人都是杂合突变,且绝大多数表现出大头畸形表征,而大头畸形也是自闭症的常见表型。小动物模型在研究CHD8缺陷造成大头畸形机制解析方面存在不一致的研究报道,而CHD8基因突变病人也未有病理学研究的报道。因此CHD8基因突变如何导致脑异常发育所致大头畸形的分子机制尚不明确。

2023年3月7日暨南大学李晓江教授团队和中国科学院遗传发育所张永清研究员团队合作在Cell Discovery杂志 (影响因子 38.079) 发表文章,题为“CHD8 mutations increase gliogenesis to enlarge brain size in the non-human primate”, (https://www.nature.com/articles/s41421-023-00525-3)。此文报道了CHD8基因突变导致食蟹猴胚胎期胶质细胞异常增多而导致大头畸形。暨南大学李邦博士、涂著池研究员和杨伟莉研究员,中国科学院遗传发育所赵晖博士同为文章共同第一作者。张永清研究员与李晓江教授为本文的共同通讯作者。美国耶鲁大学医学遗传学主任姜永辉教授,北师大认知神经科学与学习国家重点实验室教授王晓群,以及上海交大医学院松江研究院仇子龙研究员对该研究进行了点评,认为该研究成果对自闭症的病理机制及治疗提供了新的思路和治疗靶点。
神经细胞和胶质细胞的发育、成熟及增殖决定了大脑的形成与体积。过去用小鼠模型研究的结果普遍认为大头畸形与异常增加的神经细胞数量有关。 但小鼠大脑中胶质细胞与神经细胞的比例远比灵长类大脑少,而胶质细胞对灵长类大脑的形成以及功能非常重要。非人灵长类猴模型与人类在大脑结构和功能上更为接近,因此猴模型对研究自闭症和大头畸形的形成机制具有重要价值。李晓江教授与张永清研究员团队合作通过CRISPR/Cas9基因打靶方法建立了CHD8突变猴,利用分子生物学、组织病理学, 基因表达图谱,大脑影像等实验方法发现CHD8突变猴脑中胶质细胞数量显著增加,而神经细胞的数量并未受到明显影响。这一新发现提示胶质细胞过度增殖可造成大脑白质体积增加从而导致大头畸形。由于胶质细胞过度增加还可以影响神经环路功能,进而影响自闭症患者的情感认知功能,CHD8突变猴模型的制备与研究结果为未来自闭症患者大脑早期的干预治疗提供了新的思路和靶点。
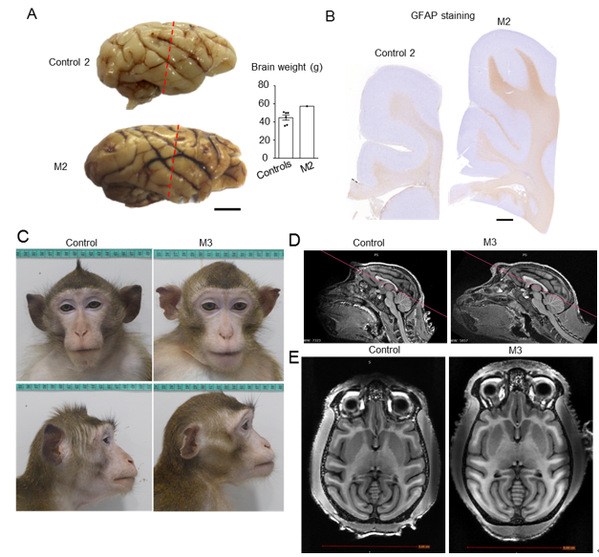
图. 免疫染色和MRI显示CHD8突变猴M2和M3白质增加造成大头畸形。
本项研究是李晓江教授与张永清研究员两个团队合作的又一新成果。由于SHANK3基因突变也可以导致自闭症。两个团队早在2017年就利用CRISPR/Cas9技术建立了世界首例SHANK3基因编辑的自闭症猴模型,并且发现SHANK3可特异性调控灵长类胚胎大脑发育(Zhao et. al., 2017, Cell Res. 影响因子 46.297)。而本研究中关于CHD8基因突变猴模型的发现再次证实了利用非人灵长类动物模型研究自闭症病理机制的必要性和不可取代性。
该研究获国家自然科学基金,科技部, 中国科学院,广东省科技厅,广州市科技局,广东省非人灵长类动物模型研究重点实验室的支持。暨南大学附属第一医院王璐教授和徐浩教授及中国科学院自动化研究所蒋田仔研究员参与猴脑影像分析。猴动物模型建立的合作单位为广东蓝岛生物技术有限公司和广州元曦生物科技有限公司。