重症联合免疫缺陷病(Severe Combined Immunodeficiency Disease, SCID)是一组遗传性免疫缺陷疾病,可导致免疫系统严重功能障碍。表现为源自胸腺和骨髓的T细胞和B细胞缺失或受损,从而影响细胞和体液适应性免疫。SCID的总体患病率估计为1/100000-2/100000。在与SCID相关的关键基因中,RAG1和IL2RG起着至关重要的作用。IL2RG对T、B和NK细胞的发育、分化和功能至关重要,而RAG1通过促进淋巴细胞成熟过程中的V(D)J重排,对适应性免疫有重要贡献。携带这些基因突变的动物模型其免疫系统均表现出明显的缺陷表型。
非人灵长类动物(Non-Human Primates, NHPs)通常被认为与人类在系统发育上具有良好的相关性,并且具有许多生理相似性,例如高度相似的免疫系统。与人类密切的遗传和生理相似性使NHPs成为生物医学研究的优秀模型。与此同时,神经退行性疾病往往会产生严重的免疫细胞变化,因此利用免疫缺陷模型研究神经退行性疾病十分重要。胞嘧啶碱基编辑器(Cytosine Base Editing,CBE)是一种强大的编辑单碱基突变的工具,已被用于在基因组中引入单碱基突变,包括在人类细胞、小鼠和作物育种中精确有效地引入单碱基突变。因此,利用该技术对IL2RG和RAG1两种基因同时进行碱基编辑,探究在食蟹猴中对IL2RG和RAG1两种基因的失活,是否能产生具有免疫缺陷表型的免疫缺陷猴模型具有重要的研究意义。
2023年9月4日,暨南大学闫森研究员/涂著池研究员等人成功地使用CBE4max系统构建了一种能够支持肿瘤生长的免疫缺陷猴模型。这些免疫缺陷猴是很有前途的工具,必将有利于生物医学和转化研究。相关的工作以“Generation of inactivated IL2RG and RAG1 monkeys with severe combined immunodeficiency using base editing”为题发表在Signal Transduction and Targeted Therapy(IF=39.3),(https://www.nature.com/articles/s41392-023-01544-y)杂志上。

研究人员通过单碱基编辑的方式对食蟹猴的胚胎IL2RG和RAG1基因突变,将CBE4max mRNA和gRNA共同注射到食蟹猴的胚胎中,通过胚胎移植到代孕母猴的方法成功获得了碱基编辑猴。碱基编辑猴的组织病理学检测也验证了碱基编辑表型的产生。同时,碱基编辑猴的免疫系统严重受损,表现出外周血淋巴细胞减少、淋巴器官萎缩和缺乏成熟的T细胞。全基因组测序的结果显示碱基编辑猴没有发生明显的脱靶效应。此外,人乳腺癌细胞在碱基编辑的猴中存活并发展为肿瘤。以上的结果显示了在食蟹猴中使用单碱基编辑技术失活IL2RG和RAG1基因可以产生具有明显免疫缺陷表型的碱基编辑猴模型。
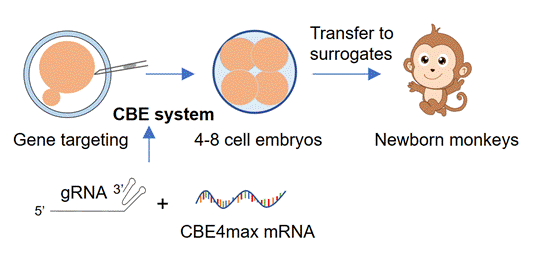
单碱基编辑食蟹猴的构建示意图
总之,该研究利用CBE4max碱基编辑系统成功地产生了具有重症联合免疫缺陷的IL2RG和RAG1基因突变猴。这些免疫缺陷猴是临床前研究的宝贵工具,并弥合了小型动物模型和人类之间的差距。它们的利用可以显著提高临床前研究的有效性,为抗癌药物的开发和再生医学领域的异源细胞或器官移植提供依据。
暨南大学粤港澳中枢神经再生研究院闫森研究员和涂著池研究员为该研究的共同通讯作者。暨南大学郑潇博士和黄春辉博士为该研究的共同第一作者。该研究受到国家重点研发计划、国家自然科学基金委、广州市脑科学重点研究计划、暨南大学、广东省科技厅,广州市科技局,广东省非人灵长类动物模型研究重点实验室的大力支持。