阿尔兹海默病(Alzheimer’s disease, AD),也叫老年痴呆,是最常见的神经退行性疾病,占总痴呆患者的50-75%。根据《The China Alzheimer Report 2022》报告,目前我国的痴呆患者约有1507万,包括983万老年痴呆患者,392万血管性痴呆以及132万其他类型的痴呆。另据统计,2015年,我国AD患者每年的社会经济花费约1677.4亿美元,预计这一数字到2030年将增长至5074.9亿美元。然而,虽然经过多年的研究努力,目前尚缺乏治有效疗手段,这无疑给患者及家庭和社会造成极大负担。
AD是一种进行性脑部疾病,典型病理学特征主要是大脑皮层和海马记忆神经区域出现大量由β淀粉样蛋白(amyloid-β,Aβ)在细胞外异常沉积形成的老年斑(senile plaques, SP),以及由Tau蛋白过度磷酸化在神经元细胞内形成的神经纤维缠结(Neurofibrillary tangles, NFTs)和突触终形成的神经纤维丝,导致神经元及其连接的丧失。这些变化和其他变化影响到人的记忆和认知能力,并最终影响独立生活的能力。目前,我们还没有完全了解大多数人患上AD的原因(散发性AD),其风险因素包括衰老、遗传、环境、生活方式、健康状况等,但这些因素的重要性在个体患病方面却因人而异。当前普遍流行的致病机制学说是Aβ假说和Tau蛋白假说,认为Aβ在脑内的沉积是AD致病的中心环节,是Tau蛋白病理和Tau介导的神经退行性病变的驱动力。然而,这两种病理改变在神经退行性疾病中的关系和因果作用仍有待明确,尽管这些改变共同或独立地发生在一些伴有认知和运动障碍的神经退行性疾病中。一个特别重要的问题是tau蛋白病变是否影响毒性Aβ低聚物的形成?
2023年9月22日,暨南大学李晓江教授,涂著池研究员和闫森研究员等人成功建立了世界首例Tau转基因猴模型,新的大动物模型必将为研究AD病理机制提供新发现。相关工作以“Tauopathy promotes spinal cord-dependent production of toxic amyloid-beta in transgenic monkeys” 为题发表在Signal Transduction and Targeted Therapy(IF=39.3)杂志上。

通过慢病毒感染猴胚胎建立了转基因Tau (P301L)食蟹猴模型,该模型发生了年龄依赖性神经变性和运动功能障碍。通过对模型猴的多个脑区进行了免疫印迹和免疫组化分析,并进行了多种行为学的检测后,发现该模型能够很好的模拟Tau蛋白异常磷酸化导致的一系列的AD样病理特征如神经纤维缠结的形成、神经元的丢失、胶质细胞的增生、突触的丧失、认知功能的障碍等。重要的是,胚胎期转基因Tau表达或立体定向脑内注射AAV-Tau导致的Tau病变选择性地促进了Aβ低聚体的产生和猴脊髓中的神经变性,而这在小鼠上并不能复现这种病理变化。该研究结果首次证明了tau蛋白病变可以引发灵长类动物脊髓中的Aβ病变,并为tau蛋白病变的发病机制和治疗提供了新的见解。
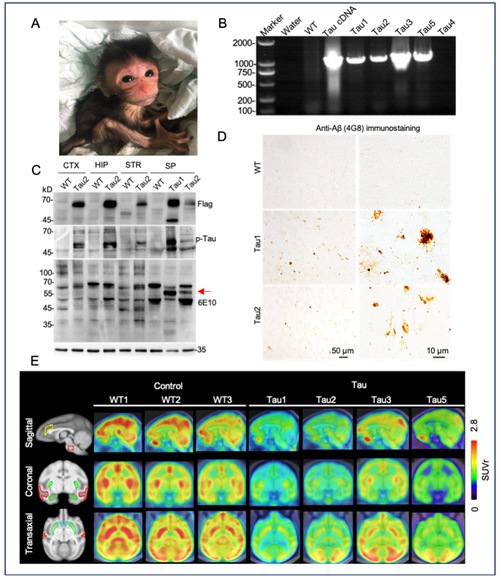
Tau P301L转基因猴及病理分析. A) 出生后一周的转基因阳性小猴,B) PCR鉴定转基因阳性猴结果,C,D) WB和免疫染色分析发现Tau转基因猴脊髓出现特异的Aβ沉积,E) [18F] FDG PET-MRI分析Tau转基因猴大脑糖代谢。
暨南大学粤港澳中枢神经再生研究院李晓江教授,涂著池研究员和闫森研究员为该研究的共同通讯作者。暨南大学韩博峰博士研究生为该研究作出重要贡献。该研究受到广州市脑科学重点研究计划、国家重点研发计划、国家自然科学基金委、暨南大学、广东省科技厅、广州市科技局,广东省非人灵长类动物模型研究重点实验室的大力支持。