2023年 11月21日,暨南大学粤港澳中枢神经再生研究院李晓江和殷鹏团队在Cell Reports(影响因子 8.8, Q1区)上发表了题为Comparing HD knockin pigs and mice reveals the pathological role of IL-17(论文链接:DOI: 10.1016/j.celrep.2023.113443)的重要研究成果,通过比较亨廷顿疾病(HD)基因敲入猪和小鼠模型,揭示了IL-17的病理作用,再次证实用大动物模型对研究人脑神经退行性疾病机制的重要性。

人口老龄化成为世界面临的巨大挑战。 越来越多的老年人罹患神经退行性疾病,包括老年痴呆( Alzheimer’s disease ) ,帕金森病(Parkinson’s disease),肌萎缩侧索硬化症), 以及单基因突变导致的遗传性亨廷顿疾病(Huntington’s disease)等。这一类疾病的共同特征是随着衰老出现脑部特异性神经细胞变性死亡最终导致病人无法生存。研究人员一直在寻找神经退行性疾病的病理机制,以便能发现有效的治疗靶点。然而,现有的研究主要基于基因修饰小鼠模型,而这些小鼠模型并不能完全模拟病人脑组织中典型神经细胞死亡特性,限制了对疾病病理的深入研究。
暨南大学李晓江团队曾在2018年建立了一种新型的亨廷顿疾病(HD) 基因敲入猪模型(Yan et al., Cell 2018),该模型能够很好的模拟HD典型病理特征,包括选择性大脑纹状体神经元丢失、反应性胶质细胞增生和轴突变性。然而,(HD) 基因敲入小鼠模型无明显神经细胞死亡,行为表型也较轻。
在本研究中,暨南大学李晓江和殷鹏团队比较了HD基因敲入猪和小鼠模型,发现与白细胞介素-17(IL-17)信号通路相关的基因在HD基因敲入猪脑中上调,而在小鼠模型脑中未见上调。这种差别与物种之间Th17 细胞分化差异而导致白细胞介素-17(IL-17)信号通路不同活性有关。进一步实验表明,将IL-17递送到HD基因敲入小鼠的纹状体中,会导致更严重的神经胶质细胞激活及突触结构和功能缺陷。这些发现表明, IL-17信号通路的功能与HD疾病进程中的严重病理有关。这为寻找新的治疗靶点提供了线索。同时,本研究还进一步证明了建立更符合人类疾病特征的动物模型用来研究神经退行性病的重要性。
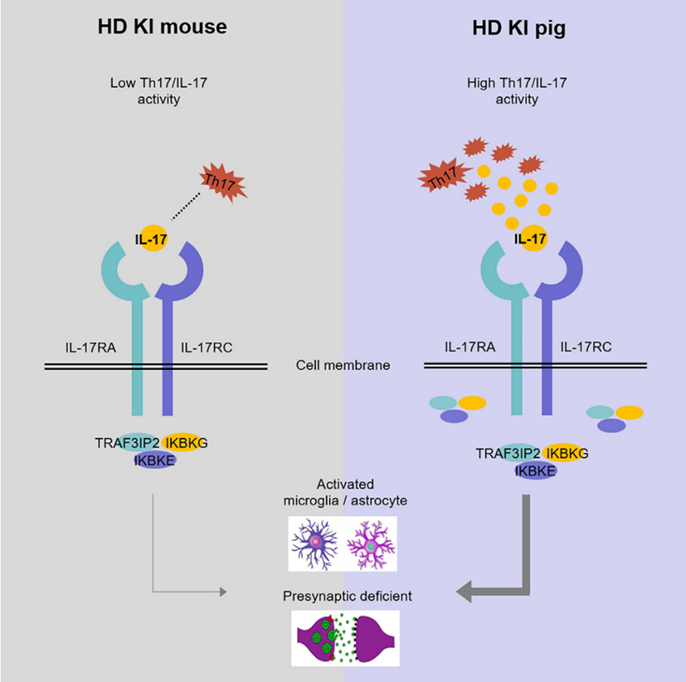
图1. 不同物种之间Th17 细胞分化差异导致了在猪中Th17/IL17细胞亚群高于小鼠,进而造成在HD基因敲入猪模型中,IL17的增加促进了神经细胞中胶质细胞的增生及神经细胞突触前膜损伤,提示IL-17 在 HD 疾病进程中的重要病理作用。
本研究论文的第一作者为暨南大学的博士生贾青青,已毕业的白大章博士和郑潇博士为共同第一作者,通讯作者包括暨南大学粤港澳中枢神经再生研究院李晓江教授,李世华教授,闫森研究员,及殷鹏研究员。该工作得到了国家自然科学基金、国家重点研发计划、广东省自然科学基金、广州市科技计划项目和暨南大学等的大力支持。