2024年 1月9 日,暨南大学粤港澳中枢神经再生研究院李晓江和殷鹏团队在国际著名期刊Cellular and Molecular Life Sciences(IF 8.0)上发表了题为Loss of TDP-43 mediates severe neurotoxicity by suppressing PJA1 gene transcription in the monkey brain(论文链接:DOI: 10.1007/s00018-023-05066-2)的重要研究成果,通过比较TDP-43基因敲除下的食蟹猴和小鼠模型,揭示了非人灵长类猴脑中TDP-43缺失通过抑制E3泛素连接酶PJA1介导神经毒性的作用。

人口老龄化成为世界面临的巨大挑战。 越来越多的老年人罹患神经退行性疾病,包括老年痴呆,帕金森病,亨廷顿疾病和肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis)等。这一类疾病的共同特征是随着衰老出现脑部特异性神经细胞变性死亡最终导致病人无法生存。研究人员一直在寻找神经退行性疾病的病理机制,以便能发现有效的治疗靶点。然而,现有的研究主要基于基因修饰小鼠模型,而这些小鼠模型并不能完全模拟病人脑组织中典型神经细胞死亡特性,限制了对疾病病理的深入研究。
例如,在肌萎缩侧索硬化症中,病人脑中可见内源性TDP-43从细胞核异常转移到胞浆并形成聚集体,造成其正常功能的丢失。李晓江和殷鹏团队前期在Acta Neuropathologica (2019,IF 18.17)报道灵长类特有的CASP4水解酶可促进TDP-43剪切,使缺失核定位信号的TDP-43片段产物累积在胞浆。然而,此现象并不表现在TDP-43转基因小鼠中。
基于上述种属间病理特征的差异,该团队比较了猴和小鼠中,核内内源性TDP-43正常功能的缺失对神经毒性的影响。通过慢病毒注射在成年猴和小鼠前额叶皮层中敲降同等比例TDP-43,发现在猴中造成的神经毒性明显高于小鼠。通过RNAseq分析表明在猴脑中,TDP-43敲降可显著抑制猴源PJA1基因的转录;但在小鼠中,因内源性TDP-43可特异结合鼠源PJA1基因启动区上游独特的重复序列(TG/GT)32,敲降TDP-43反而导致了小鼠PJA1基因的表达上调。PJA1属E3泛素连接酶家族,在物种中具有清除毒性底物的作用。PJA1表达下降可导致神经毒性底物升高。在小鼠脑中敲降PJA1,也可显著加重因TDP-43缺失造成的神经毒性。而在猴脑中过表达PJA1可在一定程度上缓解因TDP-43功能缺失造成的神经细胞死亡。PJA1保护作用的发现为寻找有效的治疗靶点提供新思路。
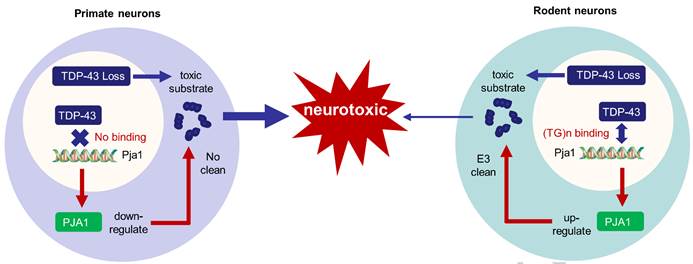
图1. 在猴和小鼠中敲降内源性TDP-43通过对PJA1的不同调节机制介导神经毒性的示意图。在小鼠神经元中,敲降TDP-43后造成鼠源PJA1基因转录上调;但在成年猴中,TDP-43敲降会诱导猴PJA1基因的表达下降,从而不能有效清除神经元中的毒性底物,造成更为显著的神经毒性。
本研究论文的第一作者为暨南大学的博士生朱龙洪,通讯作者包括暨南大学粤港澳中枢神经再生研究院李晓江教授和殷鹏研究员。该工作得到了国家自然科学基金、国家重点研发计划、广东省自然科学基金、广州市科技计划项目和暨南大学等的大力支持。